
生物安全研究专题(一)| 椿乳凝胶抗低危型人乳头瘤病毒的作用研究来源:普瑞玛 时间:2022-07-29 15:01:30 浏览:7272
人乳头瘤病毒(human papillomavirus,HPV)是一种嗜上皮组织的无包膜双链环状DNA病毒,目前已发现约200种不同HPV型别。根据其致病力的大小可以分为高危型HPV和低危型HPV。高危型HPV包括HPV16、18、26、31、33、35、39等,可以引起外生殖器癌、宫颈癌、高度外阴瘤变和其他部位的恶性病变等。低危型HPV主要包括HPV6、11、40、42、43、44等,主要引起肛门-外生殖器疣和皮肤疣等良性病变。HPV病毒的基因组按功能可分为早期编码区(E区)、晚期编码区(L区)以及非编码区。早期编码区主要负责病毒DNA的复制、转录和翻译调控,其中E6、E7在高危型HPV导致癌症中发挥重要作用。晚期编码区参与病毒衣壳蛋白的合成,包括主要衣壳蛋白L1和次要衣壳蛋白L2。 椿乳凝胶主要由椿皮、苦参、牡丹皮、乳香、冰片等中药组方而成,为名老中医多年的经验方,并且有10多年的医院制剂使用史。方中君药椿皮清热祛湿、止带。苦参、丹皮清热燥湿、止痒为臣药,以增强君药。乳香活血化瘀、生肌,冰片散热消肿、止痒为佐药,以助主药祛瘀生肌。全方具有清热燥湿、祛瘀生肌的功效,主要用于慢性宫颈炎之宫颈糜烂及中医辨证属于湿热瘀阻者。 HPV病毒具有高度的宿主和组织特异性,只能特异性感染人的黏膜、皮肤上皮细胞,并且依赖上皮细胞的分化进行复制,因此目前尚无法对HPV病毒进行有效的体外培养,同时也缺乏合适的天然动物模型,通过构建HPV假病毒成为目前研究HPV简单有效的方法。本研究通过多质粒共转染方法构建了HPV6、HPV11假病毒,对该HPV假病毒的感染能力进行了分析,并利用该假病毒成功建立了HPV感染小鼠阴道模型。通过研究椿乳凝胶对HPV6、HPV11假病毒感染的293FT细胞的形态和增殖、细胞周期的影响,以及椿乳凝胶对HPV6、HPV11假病毒感染小鼠的影响,综合评价椿乳凝胶对低危型HPV6、HPV11的药效作用,为临床用药提供参考依据.
1、材料 1.1 动物 SPF级雌性BALB/c小鼠100只,体质量15.6~18.8 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号SCXK(京)2019-0010。小鼠饲养于湖南普瑞玛药物研究中心有限公司病原微生物实验室,实验室备案编号长卫计实备字(2021)第B010号,实验动物使用许可证号SYXK(湘)2020-0015。动物研究遵循湖南普瑞玛药物研究中心有限公司动物伦理委员会的指导方针,伦理批准号IACUC-2021(3)037。 1.2 细胞 人胚肾293FT细胞购自上海中乔新舟生物科技有限公司。 1.3 仪器 BCR-MI02-72-C11-PPSU型小鼠独立通气笼盒系统、BSC1300-Ⅱ-B2型生物安全柜(山东新华医疗器械股份有限公司);ST8R型台式高速大容量冷冻离心机、实时荧光定量PCR仪、CO2培养箱(美国Thermo Fisher Scientific公司);流式细胞仪(BD公司);Spectra Max i3x型酶标仪(Molecular Devices公司);5200 Multi型化学发光成像系统、双垂直电泳仪、转印电泳仪(Tanon公司);倒置荧光显微镜(德国Leica公司);AniView100型多模式动物活体成像系统(广州博鹭腾生物科技有限公司)。 1.4 药品与试剂 椿乳凝胶(批号20191205)由株洲千金药业股份有限公司提供;报告质粒pcDNA3.1-EGFP-HPV6-E6/E7、pcDNA3.1-EGFP-HPV11-E6/E7送至通用生物(安徽)系统有限公司合成;表达质粒pCMV-HPV6-L1-flag-L2-6*His、pCMV-HPV11-L1-flag-L2-6*His送至武汉中迈盈科生物科技有限公司合成;DMEM培养基(批号AF29584966)购自HyClone公司;胎牛血清(fetal ovine serum,FBS,批号M009-6)购自Sciencell公司;Lipo-fectamine 2000(批号2117484)、细胞周期检测试剂盒(批号2117484)购自Invitrogen公司;Opti-MEM™(批号31985070)、High Capacity cDNA Reverse Transcription Kit(批号4368814)、PowerUP SYBR Green Master Mix(批号A25742)、Prestained Protein Ladder(批号26617)购自美国Thermo Fisher Scientific公司;CellTiter-Glo发光法细胞活力检测试剂盒(批号C0065M)、RIPA裂解液(强)(批号P0013B)、SDS-PAGE凝胶快速配制试剂盒(批号P0012AC)、ECL化学发光试剂盒(批号P0018A)购自碧云天生物试剂公司;DH5α感受态细胞(批号CB101)、无内毒素质粒大提试剂盒(批号DP117)购自天根生化科技(北京)有限公司;RNA提取试剂盒(批号RC101)购自Vazyme;β-actin引物(批号H309KA9183)购自生工生物工程(上海)股份有限公司;PVDF膜(批号IPVH00010)购自Merck Millipore;HRP标记的山羊抗兔IgG抗体(批号AS014)、HRP标记的山羊抗小鼠IgG抗体(批号AS003)、β-actin抗体(批号AC026)购自Abclonal公司;HPV6 E7抗体(批号LS-C144095)购自LSBio公司;HPV11 E7抗体(批号ab100967)购自英国Abcam公司;鬼臼毒素(批号M0521B)购自苏州美仑生物科技有限公司;苯甲酸雌二醇注射液(批号20190312)购自四川金科药业有限责任公司椿乳凝胶(批号20191205)由株洲千金药业股份有限公司提供;报告质粒pcDNA3.1-EGFP-HPV6-E6/E7、pcDNA3.1-EGFP-HPV11-E6/E7送至通用生物(安徽)系统有限公司合成;表达质粒pCMV-HPV6-L1-flag-L2-6*His、pCMV-HPV11-L1-flag-L2-6*His送至武汉中迈盈科生物科技有限公司合成;DMEM培养基(批号AF29584966)购自HyClone公司;胎牛血清(fetalbovine serum,FBS,批号M009-6)购自Sciencell公司;Lipo-fectamine 2000(批号2117484)、细胞周期检测试剂盒(批号2117484)购自Invitrogen公司;Opti-MEM™(批号31985070)、High Capacity cDNA Reverse Transcription Kit(批号4368814)、PowerUP SYBR Green Master Mix(批号A25742)、Prestained Protein Ladder(批号26617)购自美国Thermo Fisher Scientific公司;CellTiter-Glo发光法细胞活力检测试剂盒(批号C0065M)、RIPA裂解液(强)(批号P0013B)、SDS-PAGE凝胶快速配制试剂盒(批号P0012AC)、ECL化学发光试剂盒(批号P0018A)购自碧云天生物试剂公司;DH5α感受态细胞(批号CB101)、无内毒素质粒大提试剂盒(批号DP117)购自天根生化科技(北京)有限公司;RNA提取试剂盒(批号RC101)购自Vazyme;β-actin引物(批号H309KA9183)购自生工生物工程(上海)股份有限公司;PVDF膜(批号IPVH00010)购自Merck Millipore;HRP标记的山羊抗兔IgG抗体(批号AS014)、HRP标记的山羊抗小鼠IgG抗体(批号AS003)、β-actin抗体(批号AC026)购自Abclonal公司;HPV6 E7抗体(批号LS-C144095)购自LSBio公司;HPV11 E7抗体(批号ab100967)购自英国Abcam公司;鬼臼毒素(批号M0521B)购自苏州美仑生物科技有限公司;苯甲酸雌二醇注射液(批号20190312)购自四川金科药业有限责任公司。
2、方法 2.1 HPV6、HPV11假病毒构建 2.1.1 质粒常规转化与大量提取 从−80 ℃冰箱取出4管DH5α感受态细胞置冰上,分别向4管感受态细胞悬液中加入0.5~1 μL预冷的目的质粒,加入预热的200 μL LB液体培养基,混匀后于37 ℃、200 r/min摇床振荡1 h。吸取细胞加到含相应抗生素的LB固体培养基上,37 ℃培养12~15 h。挑取平板上单个菌落接种(或者直接取对应合成质粒的菌液100~200 μL)至2 mL含相应抗生素的LB液体培养基中培养,用无内毒素质粒大提试剂盒提取质粒,Nanodrop测定质粒纯度与浓度,于−20 ℃保存备用。
2.1.2 结构基因表达质粒与报告质粒共转染至293FT细胞 转染前1天,按1×106/mL的密度将293FT细胞铺于6孔板中,37 ℃培养过夜,待细胞长至密度约为70%时即可进行转染实验,利用Lipo-fectamine 2000将结构基因表达质粒分别与报告质粒共转染至293FT细胞,同时设置分别转染单个报告质粒为阴性对照组。①转染0.5 h之前把培养孔板中的DMEM完全培养基换成无血清的DMEM培养基,对细胞进行饥饿处理,且用量减半;②首先将转染试剂Lipofectamine 2000、对照组质粒和实验组质粒(pcDNA3.1-EGFP-HPV6/11-E6/E7:pCMV-HPV6-L1-flag-L2-6*His=1∶1,2种质粒均取1.25 μg)分别用Opti-MEM培养基进行稀释,放置5 min;③将Lipofectamine 2000分别与对照组质粒和实验组质粒混合,漩涡混匀,放置20 min;④将转染混合液加入已换成无血清培养基的培养板中,48~72 h后收获假病毒,进行病毒滴度测定。
2.1.3 病毒滴度测定 将293FT细胞按1.5×104/mL的密度铺于96孔板中,置于37 ℃、5% CO2培养箱中培养过夜。将HPV6/11假病毒用DMEM培养基分别进行1×10−1、1×10−2、1×10−3、1×10−4、1×10−5倍稀释,取各梯度病毒稀释液100 μL加入293FT细胞中,每个稀释梯度8个复孔,将96孔板放入37 ℃培养箱孵育72 h后,置于倒置荧光显微镜下观察,出现1个以上病变细胞定为阳性孔。用Reed-Muench方法计算细胞培养半数感染量(half of tissue culture infective dose,TCID50),即病毒感染一半细胞时的病毒稀释度。
2.2 椿乳凝胶体外试验 2.2.1 椿乳凝胶对293FT细胞形态及增殖的影响 将293FT细胞按1.5×104/mL的密度铺于96孔板中,置于37 ℃、5% CO2培养箱中培养过夜。待细胞长成单层细胞后,用PBS溶液洗涤细胞2~3次,将椿乳凝胶(40 mg/mL)用含10% FBS的DMEM培养基分别稀释6个质量浓度(1000、500、250、125、62.5、31.25 μg/mL);鬼臼毒素设置6个浓度(100、50、25、12.5、6.25、3.125 µmoL/L),取每组药物100 μL加入96孔板中,同时设置溶媒对照组,每组设3个复孔,置于37 ℃、5% CO2的培养箱中培养,分别于24、48、72 h后于倒置荧光显微镜下观察细胞的形态,采用CellTiter-Glo发光法测定72 h后的细胞活性,并计算椿乳凝胶和鬼臼毒素的半数抑制浓度(half inhibitory concentration,IC50)及TC0(IC20),共重复3次。
2.2.2 椿乳凝胶对HPV6、HPV11假病毒感染力的影响 将293FT细胞按1.5×104/mL的密度铺于96孔板中,置于37 ℃、5% CO2培养箱培养24 h。用培养基将椿乳凝胶(125 μg/mL)和鬼臼毒素(3.12 µmoL/L)进行多浓度稀释。待细胞长满约80%左右时弃培养液加入100倍TCID50病毒液,100 μL/孔,再加入100 μL/孔的椿乳凝胶(125 μg/mL)和鬼臼毒素(3.12 µmoL/L),同时设置溶媒对照组(单纯加入DMEM培养基),每组8个复孔,置于37 ℃、5% CO2培养箱中孵育24~72 h后。共重复3次,于倒置荧光显微镜下观察并记录实验组与对照组的细胞病变情况。
2.2.3 椿乳凝胶对293FT细胞周期的影响 将293FT细胞按1.5×106/孔的密度铺于6孔板中,置于37 ℃、5% CO2培养箱中培养过夜,待细胞长至80%左右时,用PBS溶液洗涤细胞2~3次,加入100倍TCID50病毒液,100 μL/孔。在100 μL/孔培养基中分别加入低、中、高质量浓度(32.3、64.6、129.2 μg/mL)的椿乳凝胶和鬼臼毒素(3.12 µmoL/L),同时设置病毒对照组和溶媒对照组。将细胞培养板置于37 ℃、5% CO2的培养箱中孵育48 h后,1000 r/min离心3 min收集细胞;加入10 μL碘化丙啶(PI)至终浓度20 μg/mL(用190 μL 1×Binding Buffer稀释),4 ℃避光染色30 min,离心;加入200 μL 1×Binding Buffer清洗,离心;加入200 μL PBS溶液重悬细胞,用流式细胞仪进行细胞周期数据的收集和分析(单次流式细胞仪检测,1份样品细胞数量约106)。
2.2.4 椿乳凝胶对293FT细胞凋亡的影响 将293FT细胞按1.5×106/孔的密度铺于6孔板中,置于37 ℃、5% CO2培养箱中培养过夜,待细胞长至80%左右时,用PBS溶液洗涤细胞2~3次,加入制备得到的100倍TCID50的HPV6和HPV11假病毒液,100 μL/孔。继续培养2 h后更换为低、中、高质量浓度(32.3、64.6、129.2 μg/mL)的椿乳凝胶和鬼臼毒素(3.12 µmoL/L),100 μL/孔,同时设置病毒对照组和溶媒对照组。将细胞培养板置于37 ℃、5% CO2的培养箱中孵育48 h后,1000 r/min离心3 min收集细胞,用PBS轻轻吹打洗涤细胞2次,用200 μL 1×Binding Buffer重悬细胞,再用195μL细胞悬液中加入Annexin V-FITC,室温混合孵育10min;加入200 μL 1×Binding Buffer洗涤细胞,再用190 μL 1×Binding Buffer重悬细胞,加入PI室温孵育10 min后,加入200 μL 1×Binding Buffer清洗细胞;加入200 μL PBS溶液重悬细胞,进行流式细胞仪检测,共重复3次。
2.3 椿乳凝胶对HPV6、HPV11假病毒感染BALB/c小鼠模型的影响 2.3.1 造模、分组与给药 取雌性BALB/c小鼠100只,每只动物sc 0.1 μg苯甲酸雌二醇,1次/d,连续3 d,第3天下午取25 μL HPV假病毒与15 μL 4%羧甲基纤维素(CMC)的混合物灌入小鼠阴道内进行感染,另取16只对照组小鼠灌入40 μL的4% CMC进行处理;假病毒感染48 h之后,乙醚轻微麻醉小鼠,利用多模式动物活体成像系统检测小鼠阴道内荧光的表达情况。选取造模成功的BALB/c小鼠80只,按体质量随机分为模型组、鬼臼毒素组(1 mg/只)和椿乳凝胶低、中、高剂量(0.01、0.02、0.04 g/只)组,每组16只。采用称量好的阴道装药器,经阴道推注相应的药物,每天给药1次,连续20 d。
2.3.2 pH值检测 分别于给药后10、20 d采用无菌棉签进行阴道分泌物的取样。取材部位为小鼠的宫颈口或宫颈后穹窿,分泌物使用一次性无菌阴道拭子采集,圆周滚动3次,采用0.1级精密pH试纸检测阴道分泌物的pH值
2.3.3 组织病理检查 末次给药后各组选取8只动物颈椎脱臼处死,解剖取阴道、子宫组织进行苏木素-伊红(HE)染色观察小鼠阴道、子宫及子宫颈组织形态学变化。评分标准:上皮细胞正常,且未见炎症细胞浸润,计为0分;上皮细胞坏死,计为1分;上皮细胞坏死及增生,计为2分;上皮细胞坏死及增生,且炎症细胞浸润,计为3分。
2.3.4 宫颈组织病毒滴度检测 取一定量的组织匀浆,离心取上清液,在96孔板中接种293T细胞,第2天用完全培养基按(1~1×10−9)10个梯度稀释病毒液,每孔加入100 μL稀释后的病毒液,每个梯度设置3个重复孔;48 h后观察细胞中绿色荧光蛋白(green fluorescent protein,GFP)的表达,若1×10−8梯度孔中分别有2、3、4个细胞GFP,则取平均值,此病毒滴度为3×108 TU/mL。采用血凝抑制试验检测宫颈悬液的血凝抑制滴度(以完全抑制红细胞凝集的最大稀释倍数为血凝抑制滴度),以log2(最大稀释倍数),反映宫颈中病毒效价。
2.3.5 HPV6 E6/E7、HPV11 E6/E7 mRNA检测 取各组宫颈组织,提取总RNA,逆转录为cDNA,进行PCR反应,根据Genbank里的基因数据,使用Primer Premier6和Oligo7软件设计引物序列。内参为β-actin。设定对照基因表达量为100,以目的基因占对照基因相对百分含量代表目的基因表达量。引物序列:HPV6 E6上游引物5’-TGTTTCAGGACC- CACAGGAG-3’,下游引物5’-TCACGTCGCAGT- AACTGTTG-3’;HPV6 E7上游引物5’-CAGCTC- AGA GGAGGAGGATG-3’,下游引物5’-AACCGA- AGCGTAGAGTCACA;HPV11 E6上游引物5’-CACTATAGAGGCCAGTGCCA-3’,下游引物5’-CTTGTGTTTCTCTGC GTC GT;HPV11 E7上游引物5’-CGAACCACAACGTCACACAA-3’,下游引物5’-AGAAACAGCTGCTGGAATGC-3’。
2.3.6 HPV6、HPV11 E7蛋白表达 留取样本用BCA法测定蛋白浓度,制备分离胶、浓缩胶,上样,电泳。将电泳后凝胶上的蛋白转移至聚偏二氟乙烯膜,ECL显色曝光。目的蛋白相对表达量为目的蛋白条带灰度值与β-actin条带灰度值比值。
2.3.7 统计学方法 用SPSS 22.0软件进行统计学分析,结果用表示,多组间比较采用方差分析。
3、结果 3.1 椿乳凝胶体外试验 3.1.1 HPV6、11假病毒滴度测定 HPV6/11假病毒滴度测定结果如表1所示。根据公式logTCID50=log(高于50%的死亡百分数的稀释度)+(距离比例×log稀释倍数)可知,TCID50终点稀释比例为1∶630.95,即测定HPV6/11假病毒中,每0.1 mL接种量含有630个TCID50单位。因此,把HPV6/11假病毒原液用DMEM培养基按照1∶6.3倍稀释即可得100 TCID50。 表1 HPV6/11假病毒的滴度测定出现CPE孔的统计 (, n = 8) 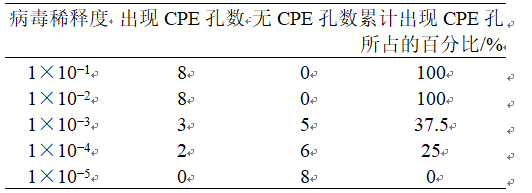
3.1.2 椿乳凝胶对293FT细胞形态及增殖的影响 如表2所示,椿乳凝胶对293FT细胞的IC50为333.80μg/mL,TC0为129.20 μg/mL,鬼臼毒素在100~3.12 μmol/L浓度对293FT细胞的毒性差异不大,试验浓度范围内未检测到鬼臼毒素对293FT细胞的IC50和TC0。加入椿乳凝胶溶液(1000~31.25 μg/mL)处理24~72 h后对293FT细胞形态的影响见图1,对照组细胞形态呈圆形,棱角分明。与对照组比较,椿乳凝胶干预组中细胞形态出现明显变化,以细胞脱落,皱缩为主,提示药物干预后细胞增殖受到一定的抑制作用。 表2 椿乳凝胶和鬼臼毒素对293FT细胞的毒性结果 (, n = 3)
图1 椿乳凝胶对293FT细胞形态的影响
3.1.3 椿乳凝胶对HPV6、HPV11假病毒感染力的影响 如图2所示,与溶媒对照组比较,病毒感染48 h后,病毒对照组细胞出现明显的增殖速度减慢,细胞碎片增多、细胞间的间隙增大等病变现象。与病毒对照组比较,椿乳凝胶干预后细胞病变程度明显减少,表明其有一定抑菌病毒增殖的能力;至培养72 h后,椿乳凝胶抑制病毒的效果呈现降低的趋势,病毒对照组与椿乳凝胶干预组出现细胞病变的差异性不大,鬼臼毒素在72 h表现出一定抑制病毒增殖的能力。提示随着时间的延长椿乳凝胶抗病毒的能力慢慢减弱,需连续给药增强药效。综上所述,椿乳凝胶对HPV6/HPV11病毒的感染有一定的抑制作用。 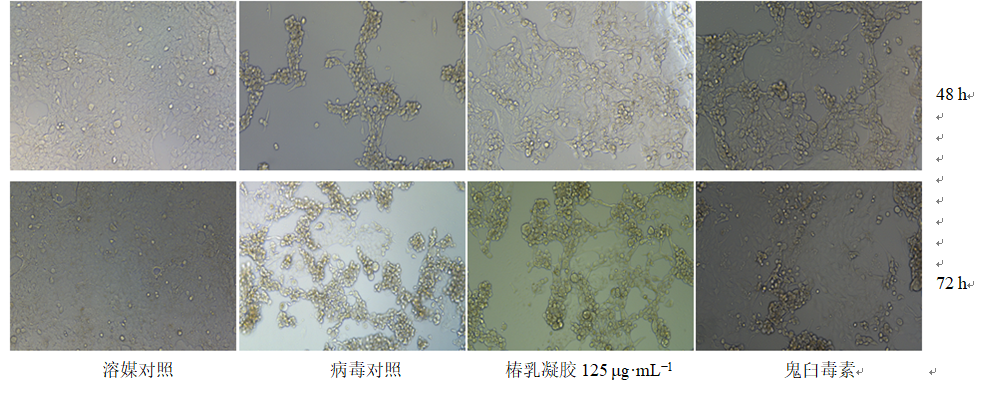
图2 椿乳凝胶对假病毒感染293FT细胞的影响
3.1.4 椿乳凝胶对293FT细胞周期的影响 PI单染流式细胞仪分析293FT细胞周期中各期细胞的变化,结果见图3。HPV6/HPV11感染48 h后,细胞中G0/G1期细胞比例显著低于溶媒对照组,S期细胞比例高于溶媒对照组,G2/M细胞比例与溶媒对照组相比无显著差异。椿乳凝胶低、中、高剂量组G0/G1期细胞比例显著高于HPV6/HPV11组,S期细胞比例低于HPV6/HPV11组,G2/M细胞比例低于HPV6/HPV11组。椿乳凝胶组G0/G1期细胞比例低于溶媒对照组,与鬼臼毒素组相比G0/G1期细胞比例无显著差异。 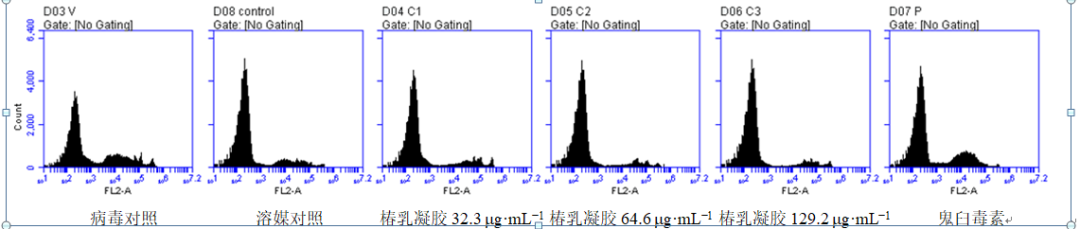
图3 PI单染流式细胞仪分析293FT细胞周期
3.1.5 椿乳凝胶对293FT细胞凋亡的影响 如图4所示,经Annexin V-FITC染色后利用流式细胞仪检测细胞凋亡情况,经假病毒处理的病毒对照组293FT细胞凋亡率明显低于溶媒对照组,提示HPV假病毒能抑制细胞凋亡。经鬼臼毒素和低、中、高剂量椿乳凝胶处理后的293FT细胞凋亡率明显高于病毒对照,并且椿乳凝胶具有剂量相关性。 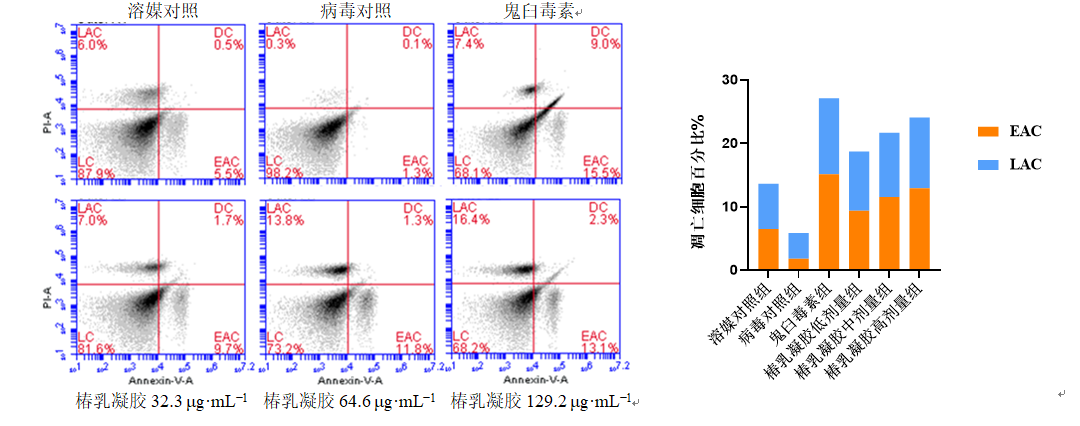
图4 椿乳凝胶对293FT细胞凋亡的影响(n=3) 3.2 椿乳凝胶体内试验 3.2.1 一般观察结果(定植检查) 造模后48 h通过动物活体成像系统对HPV定植进行检查,如图5所示,模型组荧光强度高,且造模后D22模型组荧光强度仍然较高,提示HPV在阴道体内定植良好,维持时间较长。一般临床观察显示给药后各组动物一般情况(自主活动、摄食摄水等)均未见异常,且阴道外观无明显分泌物和红肿。 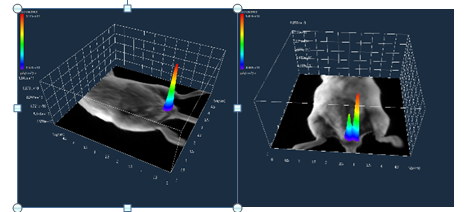
造模后48h 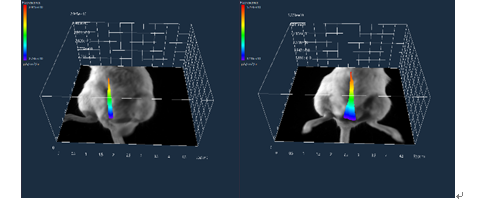
造模后D22 3.2.2 对阴道pH的影响 如表3所示,与对照组比较,给药第10、20天模型组阴道pH值明显升高(P<0.01);与模型组比较,给药第10天鬼臼毒素组和椿乳凝胶低、高剂量组阴道pH值均明显降低(P<0.05、0.01),给药第20天各给药组阴道pH值均明显降低(P<0.01)。
表3 椿乳凝胶对阴道pH值的影响 (, n = 8) 
3.2.3 对宫颈组织病毒滴度的影响 如表4所示,与对照组比较,模型组宫颈组织病毒滴度明显升高(P<0.01);与模型组比较,各给药组宫颈组织病毒滴度均明显降低(P<0.01) 表4 椿乳凝胶对宫颈组织病毒滴度的影响 (, n = 8) 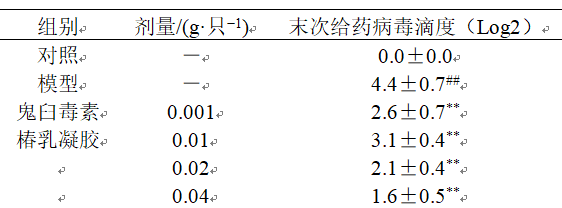
3.2.4 组织病理学镜下观察 如图6所示,对照组仅个别动物阴道及宫颈组织镜下可见黏膜上皮细胞坏死,并伴有少量炎症细胞浸润;模型组宫颈及阴道上皮细胞坏死,部分动物出现上皮细胞增生,上皮层及黏膜固有层炎症细胞浸润;各给药组阴道及宫颈组织镜下均可见黏膜上皮细胞变性坏死,伴有少量炎性细胞浸润。小鼠造模后经阴道给予不同剂量的椿乳凝胶,阴道组织病变程度变化不明显,宫颈组织病变有不同程度的减轻。连续给药20 d后,各组动物子宫组织镜下观察未见上皮细胞增生、坏死及炎症细胞浸润。 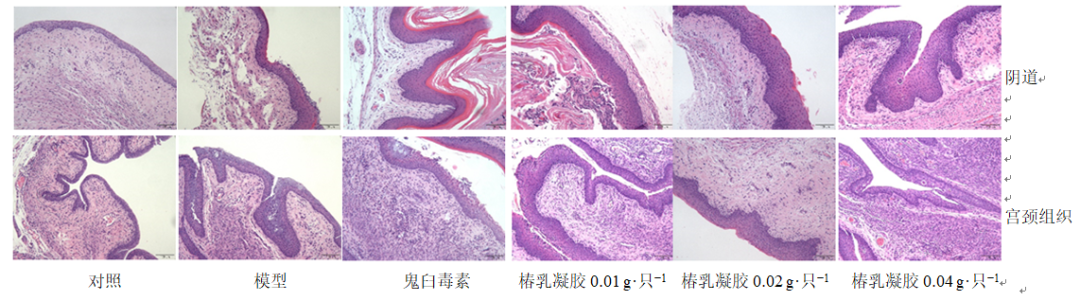
图6 各组小鼠阴道、宫颈组织病理切片 (HE, ×100)
3.2.5 组织病理学评分 如表5所示,与对照组比较,模型组宫颈组织病变评分明显升高(P<0.01),阴道组织病变评分有增加趋势,但无统计学差异;与模型组比较,鬼臼毒素组和椿乳凝胶中、高剂量组宫颈组织病变评分均明显降低(P<0.05、0.01)。各给药组阴道组织病变评分与模型组比较,均无统计学差异。 表5 椿乳凝胶对组织病变评分的影响 (, n = 8) 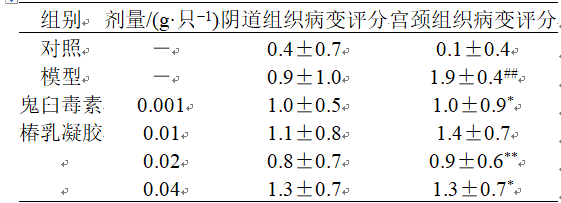
3.2.6 对HPV6、HPV11的E7蛋白表达的影响 如图7所示,与对照组比较,模型组HPV6、HPV11的E7蛋白表达水平均明显增加(P<0.01);与模型组比较,鬼臼毒素组HPV6、HPV11的E7蛋白表达水平明显降低(P<0.01),椿乳凝胶各剂量组HPV11的E7蛋白表达水平均明显降低(P<0.05、0.01),椿乳凝胶中、高剂量组HPV6的E7蛋白表达水平均明显降低(P<0.05、0.01)。 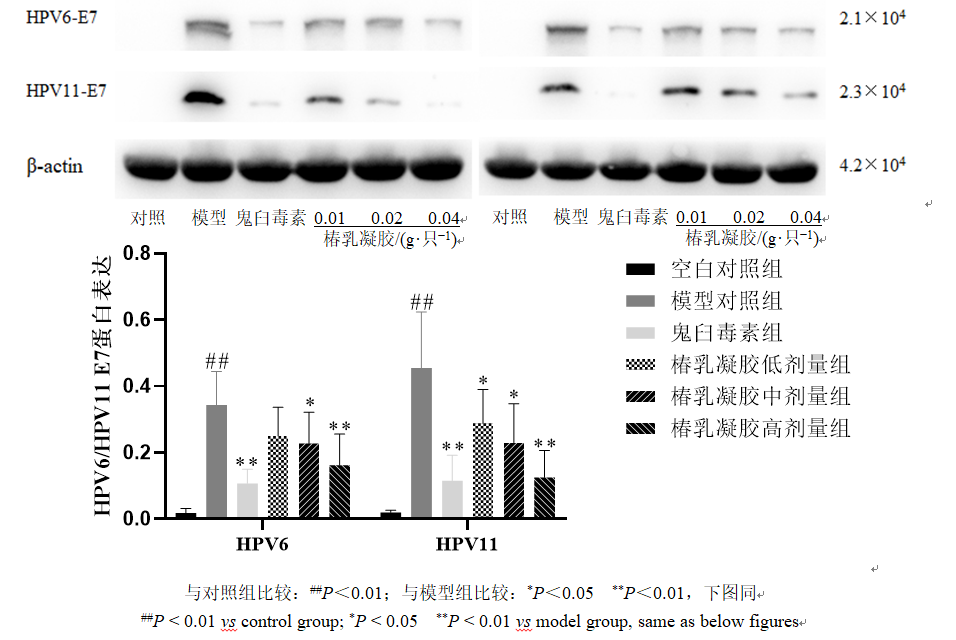
图7 椿乳凝胶对小鼠宫颈组织HPV6、HPV11 E7蛋白表达的影响(n=6)
3.2.7 对HPV6、HPV11 E6/E7 mRNA表达的影响 如图8所示,对照组组织中未检测到HPV6/HPV11 E6/E7 mRNA表达;模型组宫颈组织HPV6/HPV11 E6/E7 mRNA表达水平均明显增加(P<0.01);与模型组比较,鬼臼毒素组HPV6 E6/E7、HPV11 E7 mRNA均明显降低(P<0.05、0.01),椿乳凝胶低剂量组HPV6 E7、HPV11 E7 mRNA均明显降低(P<0.05),椿乳凝胶中、高剂量组HPV6 E6/E7、HPV11 E7 mRNA均明显降低(P<0.05、0.01)。

图8 椿乳凝胶对小鼠宫颈组织HPV6、HPV11 E6/E7 mRNA表达的影响(n=6)
4、讨论 尖锐湿疣(condyloma acuminatum,CA)也叫生殖器疣、性病疣,是一种由HPV病毒感染引起的性传播疾病,主要引起生殖器、肛门部位增生性损害。据报道,全球每10万人中就有近200人感染CA。美国每年用于CA的直接医疗费用约1.77亿美元,而在发展中国家,CA造成的影响更加严重。CA传染性强,并且有一定潜伏期,导致发病率逐年升高。目前CA治疗手段多局限于去除疣体及HPV感染组织,非针对HPV的病原学治疗,因此该病容易复发。研究表明,90%以上的CA都与HPV6和HPV11 2种基因型有关。 HPV是乳多空病毒科乳头瘤空泡病毒A属的病毒,只特异性感染人的上皮细胞,依靠上皮细胞的分化途径来完成其生命周期。HPV可能通过上皮表面的微磨损感染上皮基底层的细胞,利用伴随伤口愈合的基底细胞的横向延伸进入细胞。HPV感染上皮细胞后,癌蛋白E6、E7可以通过各种机制逃避宿主的免疫系统监测,并且将自身基因整合进人基因组,使得病毒免于被免疫系统清除。E6和E7还能共同促进细胞增殖、延长细胞周期进程并防止细胞凋亡,使得病毒大量复制。衣壳蛋白L1和L2在上皮的最表层表达,并且进行病毒组装,最后,新的感染性病毒颗粒从上皮表面脱落。 尽管目前对于HPV已经有广泛研究,然而对于低危型HPV的可用数据仍然有限。有研究显示在中国西南地区,HPV6是第二流行的HPV类型,同时也是最流行的低危型HPV。因此本研究以最常见的5种低危型HPV类型HPV6、HPV11为研究对象,评价椿乳凝胶在体内外对于低危型HPV的抑制作用。 由于HPV真病毒的复制具有严格的宿主特异性和细胞分化依赖性,因此目前并没有成功建立HPV体外培养体系,也缺乏合适的动物感染模型,构建假病毒成为目前HPV研究快速有效的方法。研究发现,将HPV结构蛋白L1、L2基因进行密码子优化后,可以极大提高其在细胞中蛋白的表达,而这2种蛋白能够自我组装成病毒样颗粒(virus-like particles,VLP),其可以将外源性报告质粒包裹进病毒颗粒内,形成与天然病毒结构相似的假病毒,具有单次感染细胞的能力,通过检测报告质粒的表达可以间接反映病毒的感染情况。 椿乳凝胶为株洲千金药业股份有限公司自主开发并独家生产的纯中药制剂,由椿皮、苦参、牡丹皮、乳香、冰片5味中药组方而成,具有清热燥湿、祛瘀生肌的功效,主要用于慢性宫颈炎之宫颈糜烂及中医辨证属于湿热瘀阻者。根据其功能主治的特点,本实验对椿乳凝胶体内及体外抗低危型HPV病毒的药效学作用展开了研究。本研究成功建立了HPV6、HPV11假病毒感染293FT细胞的体外模型,发现假病毒能使细胞产生病变,影响细胞周期变化,并且抑制细胞凋亡。椿乳凝胶干预可以显著降低假病毒细胞感染能力,恢复细胞正常周期,促进细胞凋亡。同时本研究利用HPV6、HPV11假病毒建立了雌性小鼠生殖器感染体内模型,病毒感染上皮细胞后其包裹的报告基因可以立即表达,通过小动物体内可见光成像系统检测EG FP荧光表达可以反映假病毒在上皮细胞中的感染情况。研究结果显示,HPV6、HPV11假病毒成功感染小鼠,宫颈组织中病毒滴度显著升高,并且HPV6、HPV11的E7蛋白和E6、E7基因表达水平明显升高。同时宫颈组织上皮细胞出现增生和坏死,伴有明显炎性浸润,阴道pH值明显升高,研究显示正常阴道的酸性环境可以维持阴道微环境稳态,抵御HPV感染。椿乳凝胶给药后,可以有效降低假病毒感染小鼠宫颈组织中的病毒滴度,抑制HPV6、HPV11的E7蛋白和其E6、E7基因的表达,保护宫颈上皮细胞。 综上所述,通过体内体外实验证明椿乳凝胶可以明显抑制低危型HPV复制,减轻低危型HPV感染引起的组织病变。
|